펩티드는 펩티드 결합을 통한 다수의 아미노산의 연결에 의해 형성된 화합물의 종류이다. 그들은 살아있는 유기체에서 어디에나 있습니다. 지금까지 살아있는 유기체에서 수만 개의 펩티드가 발견되었습니다. 펩티드는 다양한 시스템, 기관, 조직 및 세포의 기능적 활동을 조절하는 데 중요한 역할을하며, 생명 활동에서 종종 기능 분석, 항체 연구, 약물 개발 및 기타 분야에 사용됩니다. 생명 공학 및 펩티드 합성 기술의 발달로, 점점 더 많은 펩티드 약물이 개발되어 클리닉에 적용되었습니다.
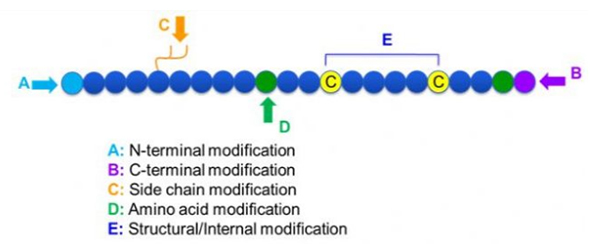
다양한 펩티드 변형이 있는데, 이는 단순히 후 변형 및 공정 변형 (유도 된 아미노산 변형 사용) 및 N- 말단 변형, C- 말단 변형, 측쇄 변형, 아미노산 변형, 골격 변형 등으로 간단히 나눌 수있다 (도 1). 펩티드 사슬의 주요 사슬 구조 또는 측쇄 그룹을 변화시키는 중요한 수단으로, 펩티드 변형은 펩티드 화합물의 물리적 및 화학적 특성을 효과적으로 변화시키고, 수용성을 증가 시키며, 생체 내 작용 시간을 연장하고, 생물학적 분포를 변화시키고, 면역 생성을 제거하고, 독성 부작용을 줄이는 등의 특성을 도입 할 수있다.
1. 사이클링
사이 클릭 펩티드는 생체 의학에 많은 적용을 가지고 있으며, 생물학적 활성을 갖는 많은 천연 펩티드는시 클릭 펩티드이다. 사이 클릭 펩티드는 선형 펩티드보다 더 단단한 경향이 있기 때문에, 소화 시스템에 매우 저항력이 있고 소화관에서 생존 할 수 있으며, 표적 수용체에 더 강한 친화력을 나타냅니다. 고리 화는 특히 큰 구조적 골격을 갖는 펩티드의 경우 사이 클릭 펩티드를 합성하는 가장 직접적인 방법이다. 순환 모드에 따르면, 측면 체인 - 사이드 체인 유형, 터미널 - 측쇄 유형, 터미널 - 터미널 유형 (끝 내지 끝에서 끝에서 끝)으로 나눌 수 있습니다.
(1) 사이드 체인-시드 체인
가장 일반적인 유형의 측쇄 내지 측쇄 사이클 화는 시스테인 잔기 사이의 이황화 브리징입니다. 이 순환은 탈포 시인 한 쌍의 시스테인 잔기에 의해 도입 된 다음 산화되어 이황화 결합을 형성한다. 폴리 사이 클릭 합성은 설페이드릴 보호 그룹의 선택적 제거에 의해 달성 될 수있다. 사이클 화는 해수 후 용매 또는 탈소 전 수지에서 수행 될 수있다. 수지의 펩티드가 순환 형태를 쉽게 형성하지 않기 때문에 수지의 순환은 용매 고리 화보다 덜 효과적 일 수있다. 다른 유형의 측쇄 - 측쇄 사이클 화는 아스파르트산 또는 글루탐산 잔기 사이의 아미드 구조의 형성이며, 이는 측쇄 보호 그룹이 수지의 또는 해리 후 폴리펩티드로부터 선택적으로 제거 할 수 있어야한다. 세 번째 유형의 측쇄-측쇄 순환은 티로신 또는 P- 하이드 록시 페닐 글리신에 의한 디 페닐 에테르의 형성이다. 천연 생성물에서 이러한 유형의 고리 화는 미생물 생성물에서만 발견되며, 고리 화 제품은 종종 잠재적 인 의약 가치를 갖는다. 이들 화합물의 제조는 독특한 반응 조건을 필요로하므로 종종 종래의 펩티드의 합성에 사용되지 않는다.

(2) 터미널-시드 체인
말기 측 사슬 순환은 일반적으로 라이신 또는 오르니틴 측쇄의 아미노기와의 C- 말단 또는 아스파르트 산 또는 글루탐산 측쇄와 N- 말단을 포함한다. 다른 폴리펩티드 순환은 말단 C와 세린 또는 트레오닌 측쇄 사이에 에테르 결합을 형성함으로써 이루어진다.
(3) 터미널 또는 머리 대 꼬리 유형
사슬 폴리펩티드는 용매에서 순환하거나 측쇄 사이클 화에 의해 수지에 고정 될 수있다. 펩티드의 올리고머 화를 피하기 위해 용매 중앙 화에 저농도의 펩티드가 사용되어야한다. 헤드 투-꼬리 합성 고리 폴리펩티드의 수율은 폴리펩티드의 사슬의 서열에 의존한다. 따라서, 사이 클릭 펩티드를 대규모로 제조하기 전에, 가능한 사슬 된 납 펩티드의 라이브러리를 먼저 만들어야하고, 그 후 사이클 화를하여 최상의 결과를 가진 서열을 찾아야한다.
2. N- 메틸화
N- 메틸화는 원래 천연 펩티드에서 발생하며 수소 결합의 형성을 방지하기 위해 펩티드 합성에 도입되어 펩티드가 생분해 및 클리어런스에 더 내성을 갖도록한다. N- 메틸화 된 아미노산 유도체를 사용한 펩티드의 합성이 가장 중요한 방법이다. 또한, 메탄올과의 N- (2- 니트로 벤젠 설포 닐 클로라이드) 폴리펩티드-레신 중간체의 미츠 노부 반응이 또한 사용될 수있다. 이 방법은 N- 메틸화 된 아미노산을 함유하는시 클릭 펩티드 라이브러리를 제조하는데 사용되었다.
3. 인산화
인산화는 본질에서 가장 흔한 번역 후 변형 중 하나입니다. 인간 세포에서, 단백질의 30% 이상이 인산화된다. 인산화, 특히 가역적 인산화는 신호 전달, 유전자 발현, 세포주기 및 세포 골격 조절 및 아 pop 토 시스와 같은 많은 세포 과정을 제어하는 데 중요한 역할을한다.
인산화는 다양한 아미노산 잔기에서 관찰 될 수 있지만, 가장 흔한 인산화 표적은 세린, 트레오닌 및 티로신 잔기이다. 포스 포티 로신, 포스 포도 레오닌 및 포스 포 세린 유도체는 합성 동안 펩티드로 도입되거나 펩티드 합성 후 형성 될 수있다. 선택적 인산화는 보호 그룹을 선택적으로 제거하는 세린, 트레오닌 및 티로신의 잔기를 사용하여 달성 될 수있다. 일부 인산화 시약은 또한 후 변형에 의해 인산기를 폴리펩티드로 도입 할 수있다. 최근 몇 년 동안, 화학적으로 선택적으로 선택적인 Staudinger-Phosphite 반응을 사용하여 라이신의 부위-특이 적 인산화가 달성되었다 (도 3).

4. Myristoylation 및 Palmitoylation
지방산으로 N- 말단의 아실화는 펩티드 또는 단백질이 세포막에 결합하도록 허용한다. N- 말단상의 미리 다야 일화 서열은 SRC 패밀리 단백질 키나제 및 역전사 효소 GAQ 단백질이 세포막에 결합하기 위해 표적화 될 수있게한다. Myristic Acid는 표준 커플 링 반응을 사용하여 수지-폴리펩티드의 N- 말단에 연결되었고, 결과적인 리포 펩티드는 표준 조건 하에서 해리되고 RP-HPLC에 의해 정제 될 수있다.
5. 글리코 실화
vancomycin 및 Teicolanin과 같은 글리코 펩티드는 약물 내성 박테리아 감염의 치료에 중요한 항생제이며, 다른 글리코 펩티드는 종종 면역계를 자극하는 데 사용됩니다. 또한, 많은 미생물 항원이 글리코 실화되기 때문에, 감염의 치료 효과를 개선하기 위해 글리코 펩티드를 연구하는 것이 큰 의미이다. 한편, 종양 세포의 세포막의 단백질은 비정상적인 글리코 실화를 나타내는 것으로 밝혀졌으며, 이는 글리코 펩티드가 암 및 종양 면역 방어 연구에서 중요한 역할을한다. 글리코 펩티드는 FMOC/T-BU 방법에 의해 제조된다. 트레오닌 및 세린과 같은 글리코 실화 잔기는 종종 펜타 플루오로 페놀 에스테르에 의해 폴리펩티드에 도입되어 글리코 실화 된 아미노산을 보호한다.
6. 이소프렌
이소 펜타 디에닐 화는 C- 말단 근처의 측쇄의 시스테인 잔기에서 발생한다. 단백질 이소프렌은 세포막 친 화성을 향상시키고 단백질-단백질 상호 작용을 형성 할 수 있습니다. 이소 펜실베이니아 주 단백질은 티로신 포스파타제, 작은 GTASE, 코카 페론 분자, 핵층 및 중심체 결합 단백질을 포함한다. 이소프렌 폴리펩티드는 수지에서 이소프렌을 사용하여 또는 시스테인 유도체를 도입함으로써 제조 될 수있다.
7. 폴리에틸렌 글리콜 (PEG) 변형
PEG 변형은 단백질 가수 분해 안정성, 생물 분포 및 펩티드 용해도를 향상시키는 데 사용될 수있다. 펩티드에 PEG 사슬의 도입은 그들의 약리학 적 특성을 향상시키고 단백질 분해 효소에 의한 펩티드의 가수 분해를 억제 할 수있다. 페그 펩티드는 사구체 모세관 단면을 일반 펩티드보다 더 쉽게 통과하여 신장 제거를 크게 감소시킨다. 생체 내에서 PEG 펩티드의 연장 된 활성 반감기로 인해, 정상 치료 수준은 더 낮은 용량 및 덜 빈번한 펩티드 약물로 유지 될 수있다. 그러나 PEG 변형은 또한 부정적인 영향을 미칩니다. 다량의 PEG는 효소가 펩티드를 분해하는 것을 방지하고 또한 펩티드의 표적 수용체에 대한 결합을 감소시킨다. 그러나 PEG 펩티드의 낮은 친화력은 일반적으로 긴 약동학 적 반감기에 의해 상쇄되며, 신체에 더 오래 존재함으로써 PEG 펩티드는 표적 조직에 흡수 될 가능성이 더 높다. 따라서 PEG 중합체 사양은 최적의 결과를 위해 최적화되어야합니다. 한편, 페그 펩티드는 신장 제거가 감소하여 간에 축적되어 거대 분자 증후군을 초래한다. 따라서, 펩티드가 약물 시험에 사용될 때 PEG 변형은보다 신중하게 설계되어야한다.

PEG 변형기의 일반적인 변형 그룹은 다음과 같이 대략적으로 요약 될 수있다 : 아미노 (아미네) -NH2, 아미노 메틸 -CH2 -NH2, 하이드 록시 -OH, 카르복시 -cooH, 설페이드 드릴 (-thiol) -SH, Maleimide -mal, succinimide carbonate -sc, succinimide acetate -scimide -scm, suminimide -propionate -spa, N- 하이드 록시 소시 니 미드 -NHS, 아크릴 레이트 -CH2CH2COOH, 알데히드 -cho (예 : 프로피온-알드, 부티럴드), 아크릴 염기 (-crylate-acrl), 아지도 아즈, 비오 티 닐-비오 틴, 플루오 레세 인, 글루 타르-가, 알키---아데이데,, 알키 네-아,, 알키 네-아르-가이데이드, 아크릴 레이트-아크로) p- 톨루엔 설포 네이트 -ots, 숙시 니 미드 숙시 네이트 -SS 등. 카르 복실 산을 이용한 PEG 유도체는 N- 말단 아민 또는 라이신 측쇄에 결합 될 수있다. 아미노-활성화 PEG는 아스파르트 산 또는 글루탐산 측쇄에 결합 될 수있다. 악성 활성화 PEG는 완전히 탈포 된 시스테인 측쇄의 Mercaptan에 접합 될 수있다 [11]. PEG 개질제는 일반적으로 다음과 같이 분류됩니다 (참고 : MPEG는 Methoxy-PEG, CH3- (CH2CH2O) N-CH2CH2-OH) :
(1) 직선 체인 페그 개질제
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) 이작 용성 PEG 개질제
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) 분지 PEG 개질제
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. 생명화
비오틴은 아비 딘 또는 스트렙 타비 딘과 강하게 결합 될 수 있으며, 결합 강도는 공유 결합에 가깝다. 비오틴-표지 된 펩티드는 면역 분석, 조직 화학 및 형광 기반 유세포 분석에서 일반적으로 사용된다. 표지 된 항생제 항체는 또한 비 오티 닐화 펩티드에 결합 하는데도 사용될 수있다. 비오틴 라벨은 종종 라이신 측쇄 또는 N 말단에 부착된다. 6- 아미노 카프로 산은 종종 펩티드와 비오틴 사이의 결합으로 사용된다. 결합은 기질에 결합하는데 유연하며 입체 방해가있을 때 더 잘 결합한다.
9. 형광 표지
형광 표지는 살아있는 세포에서 폴리펩티드를 추적하고 효소 및 작용 메커니즘을 연구하는데 사용될 수있다. 트립토판 (TRP)은 형광성이므로 고유 라벨링에 사용할 수 있습니다. 트립토판의 방출 스펙트럼은 말초 환경에 의존하고 펩티드 구조 및 수용체 결합을 검출하는데 유용한 특성 인 용매 극성 감소에 따라 감소한다. 트립토판 형광은 양성자 화 아스파르트 산 및 글루탐산에 의해 켄칭 될 수 있으며, 이는 사용을 제한 할 수있다. 염화 클로라이드 그룹 (Dansyl)은 아미노기에 결합 될 때 형광성이 높으며 종종 아미노산 또는 단백질의 형광 표지로 사용됩니다.
형광 공명 에너지 전환 (FRET)은 효소 연구에 유용합니다. FRET가 적용될 때, 기질 폴리펩티드는 일반적으로 형광-표지 그룹 및 형광 분해기를 함유한다. 라벨링 된 형광 그룹은 비 광자 에너지 전달을 통해 Quencher에 의해 켄칭된다. 펩티드가 해당 효소로부터 분리 될 때, 표지 그룹은 형광을 방출한다.
10. 케이지 폴리펩티드
케이지 펩티드는 펩티드가 수용체에 결합하는 것을 방지하는 광학적으로 제거 가능한 보호기를 갖는다. UV 방사선에 노출 될 때, 펩티드가 활성화되어 수용체에 대한 친화력을 회복시킨다. 이 광학 활성화는 시간, 진폭 또는 위치에 따라 제어 될 수 있기 때문에, 케이지 펩티드는 세포에서 발생하는 반응을 연구하는데 사용될 수있다. 케이지 폴리펩티드에 가장 일반적으로 사용되는 보호 그룹은 2- 니트로 벤질기 및 이들의 유도체이며, 이들은 보호 아미노산 유도체를 통해 펩티드 합성에 도입 될 수있다. 개발 된 아미노산 유도체는 라이신, 시스테인, 세린 및 티로신입니다. 그러나, 아스파 테이트 및 글루타메이트 유도체는 펩티드 합성 및 해리 동안 고리 화에 대한 감수성으로 인해 일반적으로 사용되지 않습니다.
11. 다방진 펩티드 (MAP)
짧은 펩티드는 일반적으로 면역이 아니며 항체를 생성하기 위해 담체 단백질에 결합되어야한다. 폴리 안원 펩티드 (MAP)는 리신 핵에 연결된 다수의 동일한 펩티드로 구성되며, 이는 고용성 면역 병원을 특이 적으로 발현 할 수 있으며 펩티드-캐리어 단백질 커플 릿을 제조하는데 사용될 수있다. MAP 폴리펩티드는 MAP 수지에서 고체 합성에 의해 합성 될 수있다. 그러나, 불완전한 커플 링은 일부 가지에서 누락되거나 잘린 펩티드 사슬을 초래하므로 원래 맵 폴리펩티드의 특성을 나타내지 않습니다. 대안으로서, 펩티드는 별도로 제조하고 정제 된 다음 매핑에 결합 될 수있다. 펩티드 코어에 부착 된 펩티드 서열은 잘 정의되고 질량 분석법에 의해 쉽게 특성화된다.
결론
펩티드 변형은 펩티드를 설계하는 중요한 수단이다. 화학적으로 변형 된 펩티드는 높은 생물학적 활성을 유지할 수있을뿐만 아니라 면역 원성 및 독성의 단점을 효과적으로 피할 수 있습니다. 동시에, 화학적 변형은 펩티드를 새로운 우수한 특성으로 부여 할 수있다. 최근 몇 년 동안, 폴리펩티드의 개정 후에 C-H 활성화 방법이 빠르게 개발되었으며, 많은 중요한 결과가 달성되었다.
후 시간 : 2025-07-03
