인산화는 세포 수명의 모든 측면에 영향을 미치며, 단백질 키나제는 신호 전달 경로 및 세포 과정을 조절함으로써 세포 내 통신 기능의 모든 측면에 영향을 미친다. 그러나 비정상 인산화는 또한 많은 질병의 원인입니다. 특히, 돌연변이 된 단백질 키나제 및 포스파타제는 많은 질병을 유발할 수 있으며, 많은 천연 독소와 병원체는 또한 세포 내 단백질의 인산화 상태를 변경함으로써 영향을 미칩니다.
세린 (SER), 트레오닌 (THR) 및 티로신 (TYR)의 인산화는 가역 단백질 변형 과정입니다. 이들은 수용체 신호 전달, 단백질 연관 및 분할, 단백질 기능의 활성화 또는 억제, 심지어 세포 생존과 같은 많은 세포 활성의 조절에 관여한다. 인산염은 음으로 하전됩니다 (인산염 그룹 당 2 개의 음전하). 따라서, 이들의 첨가는 단백질의 특성을 변화시킨다. 이는 일반적으로 구조적 변화이며 단백질의 구조를 변화시킨다. 인산염 그룹이 제거되면 단백질의 형태는 원래 상태로 돌아갑니다. 두 형태 단백질이 상이한 활성을 나타내는 경우, 인산화는 단백질이 그의 활성을 제어하기위한 분자 스위치로서 작용할 수있다.
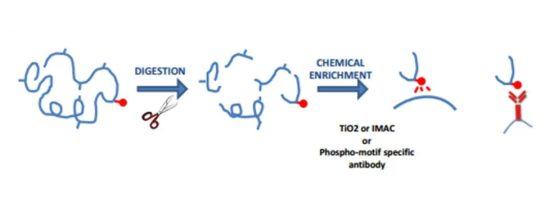
많은 호르몬은 세린 (SER) 또는 트레오닌 (THR) 잔기의 인산화 상태를 증가시킴으로써 특정 효소의 활성을 조절하고, 티로신 (Tyr) 인산화는 성장 인자 (예 : 인슐린)에 의해 유발 될 수있다. 이들 아미노산의 포스페이트 그룹은 빠르게 제거 될 수있다. 따라서, SER, THR 및 TYR은 종양 증식과 같은 세포 활성의 조절에서 분자 스위치로서 기능한다.
합성 펩티드는 단백질 키나제 기질 및 상호 작용의 연구에서 매우 유용한 역할을한다. 그러나, 고체 합성의 완전한 자동화를 달성 할 수없고 표준 분석 플랫폼과의 편리한 연결이 부족한 것과 같은 포스 포 펩티드 합성 기술의 적응성을 방해하거나 제한하는 몇 가지 요인이있다.
플랫폼 기반 펩티드 합성 및 인산화 변형 기술은 합성 효율 및 확장 성을 개선하면서 이러한 한계를 극복하고, 플랫폼은 단백질 키나제 기질, 항원, 결합 분자 및 억제제의 연구에 적합하다.
후 시간 : 2025-07-02
