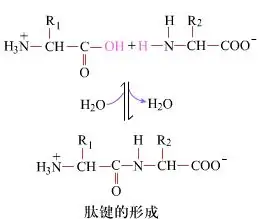
표면적으로 보면, 디펩티드를 생성하는 펩티드 결합의 형성은 단순한 화학적 과정입니다.이는 두 아미노산 성분이 탈수되면서 펩타이드 결합, 즉 아마이드 결합으로 연결되어 있다는 뜻이다.
펩타이드 결합 형성은 온화한 반응 조건에서 아미노산의 활성화입니다.(A) 카르복실 부분, 두 번째 아미노산 (B) 친핵성 활성화된 카르복실 부분은 디펩티드(AB)를 형성합니다.“카르복실 성분(A)을 보호하지 않으면 펩타이드 결합의 형성을 조절할 수 없습니다.”선형 및 고리형 펩타이드와 같은 부산물이 목적 화합물 AB와 혼합될 수 있습니다.따라서 펩타이드 결합 형성에 관여하지 않는 모든 작용기는 펩타이드 합성 중에 일시적으로 가역적인 방식으로 보호되어야 합니다.
따라서 펩타이드 합성(각 펩타이드 결합의 형성)에는 세 단계의 응집이 포함됩니다.
첫 번째 단계는 보호가 필요한 일부 아미노산을 준비하는 것이며, 아미노산의 양쪽성 이온 구조는 더 이상 존재하지 않습니다.
두 번째 단계는 펩타이드 결합을 형성하는 2단계 반응으로, N으로 보호된 아미노산의 카르복실기가 활성 중간체로 먼저 활성화된 후 펩타이드 결합이 형성되는 반응이다.이 결합 반응은 1단계 반응 또는 두 개의 순차적 반응으로 발생할 수 있습니다.
세 번째 단계는 보호 베이스를 선택적으로 제거하거나 완전히 제거하는 것입니다.모든 제거는 모든 펩타이드 사슬이 조립된 후에만 발생할 수 있지만, 펩타이드 합성을 계속하려면 보호 그룹의 선택적 제거도 필요합니다.
10개의 아미노산(Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec 및 Cys)에는 선택적 보호가 필요한 측쇄 작용기가 포함되어 있어 펩타이드 합성이 더욱 복잡해집니다.선택성에 대한 요구 사항이 다르기 때문에 임시 보호 기반과 반영구적 보호 기반을 구별해야 합니다.임시 보호기는 아미노산 또는 카르복실 작용기의 임시 보호를 반영하기 위해 다음 단계에서 사용됩니다.반영구적 보호기는 이미 형성된 펩타이드 결합이나 아미노산 측쇄를 방해하지 않고 제거되며, 때로는 합성 중에도 제거됩니다.
"이상적으로는 카르복실 성분의 활성화와 이후의 펩타이드 결합 형성(커플링 반응)이 라세미 또는 부산물 형성 없이 신속해야 하며, 높은 수율을 달성하려면 몰 반응물을 적용해야 합니다."불행히도 화학적 결합 방법 중 어느 것도 이러한 요구 사항을 충족하지 않으며 실제 합성에 적합한 방법도 거의 없습니다.
펩타이드 합성 과정에서 다양한 반응에 관여하는 작용기는 일반적으로 수동 중심에 연결되며, 글리신은 유일한 예외이며 회전의 위험이 있습니다.
펩타이드 합성 주기의 마지막 단계는 모든 보호 그룹을 제거하는 것입니다.보호기의 선택적 제거는 디펩티드 합성에서 보호의 완전한 제거에 대한 요구사항 외에도 펩티드 사슬 연장에 중요합니다.합성 전략은 신중하게 계획되어야 합니다.전략적 선택에 따라 N은 α-아미노 또는 카르복실 보호 그룹을 선택적으로 제거할 수 있습니다."전략"이라는 용어는 개별 아미노산의 축합 반응 순서를 나타냅니다.일반적으로 점진적 합성과 단편 응축에는 차이가 있습니다.펩타이드 합성("기존 합성"이라고도 함)은 용액에서 발생합니다.대부분의 경우, 펩타이드 사슬의 점진적인 연장은 펩타이드 사슬을 사용하여 더 짧은 단편을 합성함으로써만 합성될 수 있습니다.더 긴 펩타이드를 합성하려면 표적 분자를 적절한 조각으로 분할하고 C 말단의 분화 정도를 최소화할 수 있는지 확인해야 합니다.개별 조각이 점차적으로 조립된 후 목표 화합물이 결합됩니다.펩타이드 합성 전략에는 가장 좋고 가장 적합한 보호 단편의 선택이 포함되며, 펩타이드 합성 전략에는 가장 적절한 보호 염기 조합 선택과 최적의 단편 접합 방법 선택이 포함됩니다.
게시 시간: 2023년 7월 19일